物质检验的方法方面(化学中物质的常见检验方法)
1.化学中物质的常见检验方法
物质的常见检验方法笼统地讲有:物理法、化学法。
物理法就是利用物理性质检验,如颜色、气味、水溶性。
化学法就是利用特征反应检验。
具体举例如下:
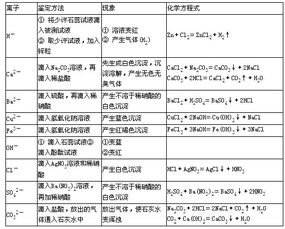
一、离子的检验
1、钠离子、钾离子,用焰色反应。火焰颜色分别呈黄色、紫色(通过蓝色钴玻璃片)。
2、镁离子,能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。
3、铝离子,能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸和过量的NaOH溶液。
4、铁离子,能与KSCN溶液反应,变为血红色Fe(SCN)3。或者与NaOH溶液反应生成红褐色沉淀。
5、亚铁离子,与NaOH溶液反应,先生成白色Fe (OH)2沉淀,迅速变灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐溶液中加入KSCN溶液,不显红色,加入少量新制的氯水后立即显红色。
6、NH4+,铵盐与氢氧化钠溶液反应,并加热,放出使湿润的红色石蕊试纸变蓝的刺激性气味气体。
7、cl-,能与硝酸银反应生成不溶于硝酸的白色沉淀。
8、Br-,能与硝酸银反应生成不溶于硝酸的淡黄色沉淀。
9、I-,能与硝酸银反应生成不溶于硝酸的黄色沉淀。
10、硫酸根,能与Ba(OH)2及可溶性钡盐反应,生成不溶于硝酸的白色沉淀。
11、碳酸根,能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于稀盐酸,且放出无色无味的气体,能使澄清的石灰水变浑浊。
二、气体物质的检验
1、观察法:对于有特殊颜色的气体如氯气(黄绿色)、二氧化氮(红棕色)、碘蒸气(紫红)可根据颜色检验。
2、溶解法:根据溶于水现象检验。例如红棕色二氧化氮溶于水后溶液无色,红棕色溴蒸汽溶于水形成橙色溶液。
3、褪色法:例如SO2可以使品红溶液褪色。
4、氧化法:被空气氧化看变化,例如NO的检验。
5、试纸法:如石蕊试纸,醋酸铅试纸。
6、星火法:适用于有助燃性或可燃性的气体。例如O2使带火星木条复燃;甲烷、乙炔的检验可点燃看现象;甲烷、一氧化碳、氢气则可根据其燃烧产物来判断。
还有一些方法,如闻气味等,但一般不用。
2.有哪些鉴别物质的方法
5.溶解法
利用物质的溶解情况进行鉴别。
6.溶解热法
利用物质溶于水,放热或吸热情况不同,予以鉴别。
例:如何用水鉴别NH4NO3固体和KCl固体。
解:将两种固体分别溶于水,水温有明显降低的是NH4NO3,无明显变化的是KCl。
7.密度法
根据物质密度不同而进行鉴别。
例:水和苯是两种不相溶的液体,密度是水大于苯。如何进行鉴别,不能用试剂和加热。
解:取一试管,倒入等量两种液体,此时分为等量两层,下层是水,上层是苯,再加入任何一种液体,若上层增多,则加入的是苯;若下层增多,则加入的是水。
8.丁达尔法
根据胶体有丁达尔现象,鉴别胶体和其它分散系。
9.凝聚法
加入电解质而使胶体发生凝聚,进行鉴别。
例:如何区别Fe(OH)3胶体和FeCl3溶液。
解:两种液体分盛于二试管中,滴入几滴Na2SO4溶液,有红褐色沉淀产生,则试管内放的是Fe(OH)3胶体。若无这种现象的是FeCl3溶液。
10.颜色法
物质颜色不同,或与其它物质反应,生成不同颜色,达到鉴别的目的。
例1:有两瓶无色溶液,NaCl和NaBr,请予鉴别。
用AgNO3溶液鉴别。反应的离子方程式:
Ag++Cl-=AgCl(白色)↓
Ag++Br-=AgBr(浅黄色)↓
11.加热法
利用物质热稳定性不同,进行鉴别。
例:不用任何化学试剂,如何鉴别失落标签的二种固体物质是明矾和硫酸铝。
解:将二种固体分别放入试管中,加热,试管口有水珠出现的,是明矾,无此现象的是硫酸铝。反应的化学方程式:KAl(SO2)2·12H2OKAl(SO4)2+12H2O
12.焰色法
根据离子或单质的焰色反应,加以鉴别。
13.燃烧法
利用物质燃烧颜色不同或其它现象,予以鉴别。
例:如何区分两种无色气体:H2和C2H2。
解:将两种气体分别点燃,有较多浓烟的是C2H2,无烟的是H2。(也可根据H2和C2H2燃烧时焰色不同进行鉴别)。
14.熔、沸点法
利用物质熔、沸点不同而区别的方法。
例:水和二硫化碳的鉴别。
解:将两种液体取少量,倒在表面皿上,过一会,有一液体立即挥发,是CS2;反之,不挥发的是H2O。
15.闻气味法
根据物质气味不同而进行鉴别的方法。
16.指示剂法
根据溶液的酸碱性,用指示剂进行鉴别的方法。
17.氧化法
利用氧化剂,使被测物质发生氧化反应,再根据实验现象进行鉴别的方法。
例:怎样鉴别KCl和KBr溶液。
用通入Cl2的方法鉴别。反应的离子方程式:Cl2+2Br-=Br2+2Cl-
18.还原法
利用还原剂,使被鉴别物质发生还原反应,再根据现象予以鉴别。
例:怎样鉴别FeCl2和CuCl2溶液。
解:在盛有FeCl2和CuCl2溶液的两支试管中,通过往试样溶液中分别放入铁片的方法鉴别。
19.磁体法
根据物质的磁性,进行鉴别的方法。
20.碳化法
利用浓硫酸的脱水性和吸水性,区别其它物质。
3.质量检验的主要方法有哪些
质量检验的方式可以按不同的特征进行分类。
一、按检验数量划分 1、全数检验 全数检验使指对一批待检产品进行检验。这种方式,一般来说比较可靠。
同时能够提供较全面的质量信息。如果希望检查得到百分之百的合格品,唯一可行的办法就是进行全检,甚至一次以上的全检。
但是还要考虑漏检和错检的可能。全数检验有它固有的缺点: 第一,检验的工作量大; 第二,检验周期长; 第三,检验成本高; 第四,要求检验人员和检验设备较多; 第五,较大的漏检率和错检率; 由于检验人员长期重复检验的疲劳,工作枯燥,检验人员技术检验水平的限制,检验工具的迅速磨损,可能导致较大的漏检率和错检率。
具国外统计,这种漏检率和错检率有时可能会达到10%到15%。 第六,全检不适合破坏性的检验项目。
通常全检适用于以下几种场合: 第一,精度要求高的产品和零部件; 第二,对下道或后续工序影响较大的尺寸部位; 第三,手工操作比重大,质量不稳定的工序; 第四,一些批量不大,质量方面无可靠保证的产品(包括零部件)和工序 第五,采用挑选型抽样方案时,对于不合格的交验批,要进行100%的重检和筛选。
质量检验的方式可以按不同的特征进行分类。一、按检验数量划分 1、全数检验 全数检验使指对一批待检产品进行检验。
这种方式,一般来说比较可靠。同时能够提供较全面的质量信息。
如果希望检查得到百分之百的合格品,唯一可行的办法就是进行全检,甚至一次以上的全检。但是还要考虑漏检和错检的可能。
全数检验有它固有的缺点: 第一,检验的工作量大; 第二,检验周期长; 第三,检验成本高; 第四,要求检验人员和检验设备较多; 第五,较大的漏检率和错检率; 由于检验人员长期重复检验的疲劳,工作枯燥,检验人员技术检验水平的限制,检验工具的迅速磨损,可能导致较大的漏检率和错检率。具国外统计,这种漏检率和错检率有时可能会达到10%到15%。
第六,全检不适合破坏性的检验项目。 通常全检适用于以下几种场合: 第一,精度要求高的产品和零部件; 第二,对下道或后续工序影响较大的尺寸部位; 第三,手工操作比重大,质量不稳定的工序; 第四,一些批量不大,质量方面无可靠保证的产品(包括零部件)和工序 第五,采用挑选型抽样方案时,对于不合格的交验批,要进行100%的重检和筛选。
2、抽样检验 抽样检验是指根据数理统计原理所预先制定的抽样方案。从交验的一批产品中,随机抽取部分样品进行检验,根据检验结果,按照规定的判断准则,判定整批产品是否合格,并决定是接收还是拒收该批产品,或采取其它吃力方式。
抽样检验的主要优点是,明显节约了检验工作量和检验费用,缩短了检验周期,减少了检验人员和设备。特别是属于破坏性检验时,只能采取抽样检验的方式。
抽样检验的主要缺点,是有一定的错判风险。例如将合格判为不合格,或把不合格错判为合格。
虽然运用数理统计理论,在一定程度上减少了风险,提高了可靠性,但只要使用抽检方式,这种风险就不可能绝对避免的。 抽样检验适用于一下几种场合: 第一,生产批量大,自动化程度高,产品质量比较稳定的产品或工序; 第二,带有破坏性检验的产品和工序; 第三,外协件、外购件成批的验收检验; 第四,某些生产效率高,检验时间长的产品和工序; 第五,检验成本太高的产品和工序; 第六,产品漏检少量不合格不会引起重大损失的产品。
二、按质量特性值划分 1、计数检验 计数检验包括检查和计点检查,只记录不合格数(或点),不记录检测后的具体测量数值,特别是有些质量特性本身很难用数值表示,如产品的外形是否美观,食物的味道是否可口等等,它们只能通过感官判断是否合格,还有一类质量特点,如产品的尺寸等虽然可以用数值表示,也可以进行测量,但在大批量生产中,为了提高效率、节约人力和费用,常常只用“过端”和“不过端”的卡规检查是否在上下公差范围以内,也就是只区分合格与不合格品,而不测量实际的尺寸大小。 2、计量检验 计量检验就是测量和记录质量特性的数值,并根据数值与表准对比,判断是否合格。
这种检验在工业生产中是大量而广泛存在的。三、按检验性质划分 1、理化检验 理化检验是借助物理、化学的方法,使用某种测量工具或仪器设备,如千分尺、游标卡尺、显微镜等等所进行检验,理化检验的特点通常都是能够得到具体的数值,人为误差小因而有条件时,要尽可能的采用理化检验。
2、官能检验 管能检验时靠人的感觉器官来对产品的质量进行评价和判断的。如对产品的形状、颜色、味道、气味、伤痕、老化程度等,通常时依靠人的视觉、听觉、触觉和嗅觉等感觉器官进行检查的,并判断质量的好坏或是否合格。
官能检验又可以分为两类: 第一类、嗜好形官能检验,如美不美、香不香,这类由人的感觉本身作为判断对象的检验,这种检验往往因人而异,因为每个人的嗜好可能不同,如每个人都有不同的审美观,对同一事物,其判断的结果可能由所不同。也就是说,这类检验往往由较强的主观意愿。
第二类、分析型官能检验,通过人的感觉。
4.化学中物质的常见检验方法
物质的常见检验方法笼统地讲有:物理法、化学法。
物理法就是利用物理性质检验,如颜色、气味、水溶性。化学法就是利用特征反应检验。
具体举例如下:一、离子的检验1、钠离子、钾离子,用焰色反应。火焰颜色分别呈黄色、紫色(通过蓝色钴玻璃片)。
2、镁离子,能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。3、铝离子,能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸和过量的NaOH溶液。
4、铁离子,能与KSCN溶液反应,变为血红色Fe(SCN)3。或者与NaOH溶液反应生成红褐色沉淀。
5、亚铁离子,与NaOH溶液反应,先生成白色Fe (OH)2沉淀,迅速变灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐溶液中加入KSCN溶液,不显红色,加入少量新制的氯水后立即显红色。
6、NH4+,铵盐与氢氧化钠溶液反应,并加热,放出使湿润的红色石蕊试纸变蓝的刺激性气味气体。7、cl-,能与硝酸银反应生成不溶于硝酸的白色沉淀。
8、Br-,能与硝酸银反应生成不溶于硝酸的淡黄色沉淀。9、I-,能与硝酸银反应生成不溶于硝酸的黄色沉淀。
10、硫酸根,能与Ba(OH)2及可溶性钡盐反应,生成不溶于硝酸的白色沉淀。11、碳酸根,能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于稀盐酸,且放出无色无味的气体,能使澄清的石灰水变浑浊。
二、气体物质的检验1、观察法:对于有特殊颜色的气体如氯气(黄绿色)、二氧化氮(红棕色)、碘蒸气(紫红)可根据颜色检验。2、溶解法:根据溶于水现象检验。
例如红棕色二氧化氮溶于水后溶液无色,红棕色溴蒸汽溶于水形成橙色溶液。3、褪色法:例如SO2可以使品红溶液褪色。
4、氧化法:被空气氧化看变化,例如NO的检验。5、试纸法:如石蕊试纸,醋酸铅试纸。
6、星火法:适用于有助燃性或可燃性的气体。例如O2使带火星木条复燃;甲烷、乙炔的检验可点燃看现象;甲烷、一氧化碳、氢气则可根据其燃烧产物来判断。
还有一些方法,如闻气味等,但一般不用。
声明:本网站尊重并保护知识产权,根据《信息网络传播权保护条例》,如果我们转载的作品侵犯了您的权利,请在一个月内通知我们,我们会及时删除。
蜀ICP备2020033479号-4 Copyright © 2016 学习鸟. 页面生成时间:4.664秒









