消解样品的(样品前处理的常用消解体系酸消解法)
1.样品前处理的常用消解体系酸消解法
原发布者:laykey
样品前处理的常用消解体系酸消解法酸消解法酸消解法包括敞口酸消解法和高压密闭酸消解法。敞口酸消解法是应用最普遍的一种样品分解方法。利用各种酸的化学能力,将待测的金属元素从样品中溶解出来转移到液体中。酸消解法常用的酸的种类和性质如下:(1)硝酸HN03(相对密度1.42,70%水溶液,m/m),沸点120℃在常压下的沸点为120℃,在0.5MPa下,温度可达176℃,它的氧化电位显著增大,氧化性增强。能对无机物及有机物进行氧化作用。金属和合金可用硝酸氧化为相应的硝酸盐,这些硝酸盐通常易溶于水。部分金属元素,如Au,Pt,Nb,Ta,Zr不被溶解。AI和Cr不易被溶解。硝酸可溶解大部分的硫化物。(2)盐酸HCl(相对密度1.19,37%水溶液,m/m),沸点110℃盐酸不属于氧化剂,通常不消解有机物。盐酸在高压与较高温度下,可与许多硅酸盐及一些难溶氧化物、硫酸盐、氟化物作用,生成可溶性盐。许多碳酸盐、氢氧化物、磷酸盐、硼酸盐和各种硫化物都能被盐酸溶解。(3)高氯酸HC104(相对密度1.67,72%水溶液,m/m),沸点130℃HC104是己知最强的无机酸之一。经常使用HCIO4来驱赶HCI,HN03和HF,而HC104本身也易于蒸发除去,除了一些碱金属(K,Rb,Cs)的高氧酸盐溶解度较小外,其他金属的高氯酸盐类都很稳定且易溶于水。用HC104分解的样品中,可能会有10%左右的Cr以CrOC13的形式挥发掉,V也可能会以VOCI3的形式挥发。HC104是一种强氧化剂,热的浓HC104氧化性极强,会和有机化合物发生强烈(爆炸
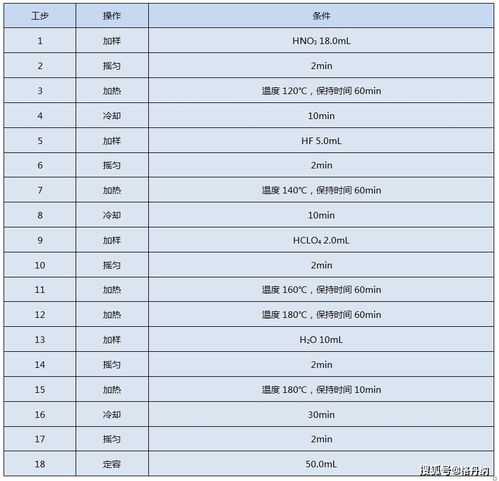
2.总氮测定时,消化至关重要,样品消化时注意事项有哪些
碱性过硫酸钾的配制十分关键,配制不准,会影响消解效果,也就影响测定结果。1S;;=TUQ=T中,规定了碱性过硫酸钾的配制[!],但交待简单,只介绍将过硫酸钾和氢氧化钠溶于无氨水中,定容,并未明确其要求。实际测定过程中,过硫酸钾的溶解速度非常慢,为要快速溶解,必须采用水浴加热,且保持水浴在%"Y以下,否则过硫酸钾会分解。在配制该溶液时,可分开配制过硫酸钾溶液和氢氧化钠溶液,再混合定容。或者先配制氢氧化钠溶液,待其温度降到%"Y以下,
再加入过硫酸钾溶解。若将二者在一只烧杯中水溶,应缓慢加水,并不断搅拌,以防氢氧化钠放热,使溶液温度过高而引起局部过硫酸钾分解。
要注意对过硫酸钾的保存,应放在聚乙烯瓶中,并避免与还原性物质、酸性物质等存放在一起。过硫酸钾易潮解,应保存在干燥的试剂橱中。

声明:本网站尊重并保护知识产权,根据《信息网络传播权保护条例》,如果我们转载的作品侵犯了您的权利,请在一个月内通知我们,我们会及时删除。
蜀ICP备2020033479号-4 Copyright © 2016 学习鸟. 页面生成时间:3.844秒









