滴定(滴定细节是什么)
1.滴定细节是什么
滴定是眼睛应该看这锥形瓶,注意指示剂颜色的变化,注意:不要看滴定管内试剂刻度的变化,那时滴定结束后的事情。
滴定的细节:
1.酸式滴定管涂油的方法是什么?
答: 将活塞取下,用干净的纸或布把活塞和塞套内壁擦干,用手指蘸少量凡士林在活塞的两头涂上薄薄一圈, 在紧靠活塞孔两旁不要涂凡士林,以免堵隹活塞孔,涂完,把活塞放回套内,向同一崐方向旋转活塞几次,使凡士林分布均匀呈透明状态,然后用橡皮圈套住,将活塞固定在塞套内,防止滑出.
2.酸式滴定管如何试漏?
答:关闭活塞,装入蒸馏水至一定刻线,直立滴定管约2min,仔细观察刻线上的液面是否下降,滴定管下端有无水滴滴下,及活塞隙缝中有无水渗出, 然后将活塞转动180°等待2min再观察,如有漏水现象应重新擦干涂油
3.碱式滴定管如何试漏?
答: 装蒸馏水至一定刻线,直立滴定管约2min,仔细观察刻线崐上的液面是否下降,或滴定管下端尖嘴上有无水滴滴下,如有漏水,则应调换胶管中玻璃珠,选择一个大小合适比较圆滑的配上再试,玻璃珠太小或不圆滑都可能漏水,太大操作不方便.
4.酸式滴定管如何装溶液?
答:装之前应将瓶中标准溶液摇匀,使凝结在瓶内壁的水混入溶液, 为了除去滴定管内残留的水分,确保标准溶液浓度不变,应先用此标准溶液淋洗滴定管2--3次,每次用约10mL,从下口放出少崐量(约1/3) 以洗涤尖嘴部分,应关闭活塞横持滴定管并慢慢转动,使溶液与管内壁处处接触,最后将溶液从管口倒出弃去,但不要打开活塞, 以防活塞上的油脂冲入管内.尽量倒空后再洗第二次,每崐次都要冲洗尖嘴部分, 如此洗2--3次后,即可装入标准溶液至"0"刻线以上.
5.碱式滴定管如何赶气泡?
答:碱式滴定管应将胶管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴喷出,以排除气泡.碱式滴定管的气泡一般是藏在玻璃珠附近,崐必须对光检查胶管内气泡是否完全赶尽, 赶尽后再调节液面至崐0.00mL处,或记下初读数.
6.滴定的正确方法?
答:滴定时,应使滴定管尖嘴部分插入锥形瓶口(或烧杯口)下崐1--2cm处, 滴定速度不能太快,以每秒3--4滴为宜,切不可成液柱流下, 边滴边摇.向同一方向作圆周旋转而不应前后振动,因那样崐会溅出溶液.临近终点时,应1滴或半滴地加入,并用洗瓶吹入少量冲洗锥形瓶内壁, 使附着的溶液全部流下,然后摇动锥形瓶,观察终点是否已达到.如终点未到,继续滴定,直至准
确到达终点为止.
7.滴定管读数应遵守下列规则?
答:(1)注入溶液或放出溶液后,需等待30s--1min后才能读数崐(2) 滴定管应垂直地夹在滴定台上读数或用两手指拿住滴定管的上端使其垂直后读数(3)对于无色溶液或浅色溶液,应读弯月面下缘实际的最低点,对于有色溶液,应使视线与液面两侧的最高点相崐切,初读和终读应用同一标准.
8.滴定管使用注意事项?
答: (1)用毕滴定管后,倒去管内剩余溶液,用水洗净,装入蒸馏水至刻度以上, 用大试管套在管口上,这样,下次使用前可不必再用洗液清洗.(2)酸式滴定管长期不用时,活塞部分应垫上纸.否崐则,时间一久,塞子不易打开,碱式滴定管不用时胶管应拔下,蘸些滑石粉保存.
我看你需要看一些化验员基础知识和入门的东西
2.酸碱中和滴定有哪些重要的知识点
【知识点1】中和滴定的概念及原理
1.概念:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法。 2.实质:中和反应。
3.关键: ①准确测定标准液和待测溶液的体积;
②准确判断:反应的终点。
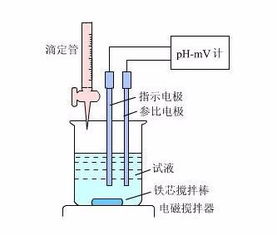
【知识点2】滴定管
①酸式滴定管——酸性或具有氧化性的物质, 碱式滴定管——碱性或具有还原性的物质。 ②精确度——0.01ml
③洗涤——滴定管在使用前经检查后要进行洗涤,须先用蒸馏水,然后再用待盛液润洗2~3次。但锥形瓶用蒸馏水洗净后不能再用待盛液润洗,否则将会引起误差。
【知识点3】中和滴定的仪器和药品
1.仪器:酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、烧杯等
2.试剂: 标准液、待测液、指示剂;
【知识点4】指示剂的选择: 变色要灵敏、明显,
一般强酸滴定强碱用指示剂选用酚酞。 中和滴定,肯定不用石蕊 【知识点4】中和滴定的操作(以标准盐酸滴定NaOH为例) 1.准备:①洗涤 ②查漏 ③润洗 ④装液体 ⑤排气泡 ⑥调整液面 ⑦读数
2.滴定:①量取待测液并加指示剂 ②滴定至终点并读数
③重复操作三次 ④计算
【注意】
①滴定时在瓶底垫一张白纸;
②滴定时左手控制旋钮、右手振荡锥形瓶、目光注视锥形瓶内溶液颜色变化。
③锥形瓶:只用蒸馏水洗涤,不能用待测液润洗 ④先快后慢,当接近终点时,应一滴一摇
⑤注入标准液至“0”刻度上方2~3cm处,将液面调节到“0”刻度(或“0”刻度以下某一刻度)
【知识点5】滴定终点判断
当最后一滴刚好使指示剂颜色发生明显的改变而且半分钟内不恢复原来的颜色,即为滴定终点。 【知识点6】中和滴定的误差分析
3.什么是滴定分析,其基本操作是什么
滴定是一种化学实验操作也是一种定量分析的手段。
它通过两种溶液的定量反应来确定某种溶质的含量。滴定最基本的公式为:c1·V1 / ν1 = c2·V2 / ν2其中c为溶液浓度,V为溶液体积,ν为反应方程序中的系数。
滴定过程需要一个定量进行的反应,此反应必须能完全进行,且速率要快,也就是平衡常数、速率常数都要较大。而且反应还不能有干扰测量的副产物、副反应。
在两种溶液的滴定中,已知浓度的溶液装在滴定管里,未知浓度的溶液装在下方的锥形瓶里。通常把已知浓度的溶液叫做标准溶液,它的浓度是与不易变质的固体基准试剂滴定而测得的。
反应停止时,读出用去滴定管中溶液的体积,即可用公式算出浓度。根据反应类型的不同,滴定分为以下种类:-酸碱中和滴定(利用中和反应) (指示剂常用甲基橙、酚酞)-氧化还原滴定(利用氧化还原反应)-沉淀滴定(利用生成沉淀的反应)-络合滴定(利用络合反应)滴定反应需要灵敏的指示剂来指示反应的完成。
指示剂在反应完成时,会迅速变成另一种颜色。这样实验者就可以根据指示剂的变色来确定反应的终止。
中和滴定的指示剂是有机弱酸或弱碱,它们的变色范围在等电点附近。如弱酸的变色(以HIn代表):HIn (酸色形) = H+ + In-(碱色形)指示剂一般有两种形态,两种形态呈现不同的颜色。
指示剂在变色范围内呈现过渡色。有的指示剂有三种不同颜色的形态。
由于在变色范围时会发生“突跃”现象,颜色会变得很迅速,只要1滴溶液就可以让指示剂完全变色,因此选择指示剂时,只需让反应完成时的pH值落在突跃范围内即可,不必苛求准确。其他种类滴定的指示剂一般是与某种反应物有灵敏反应的物质。
当反应物消耗完毕时,指示剂就会变色。甚至有些反应物也可以作为指示剂,如高锰酸钾(少见) 进行滴定时,应将滴定管垂直地夹在滴定管架上。
如使用的是酸管,左手无名指和小手指向手心弯曲,轻轻地贴着出口管,用其余三指控制活塞的转动。但应注意不要向外拉活塞以免推出活塞造成漏水;也不要过分往里扣,以免造成活塞转动困难,不能操作自如。
如使用的是碱管,左手无名指及小手指夹住出口管,拇指与食指在玻璃珠所在部位往一旁(左右均可)捏乳胶管,使溶液从玻璃珠旁空隙处流出。注意:①不要用力捏玻璃珠,也不能使玻璃珠上下移动;②不要捏到玻璃珠下部的乳胶管;③停止滴定时,应先松开拇指和食指,最后再松开无名指和小指。
无论使用哪种滴定管,都必须掌握下面三种加液方法:①逐滴连续滴加;②只加一滴;③使液滴悬而未落,即加半滴。滴定操作中应注意以下几点:⑴ 摇瓶时,应使溶液向同一方向作圆周运动(左右旋转均可),但勿使瓶口接触滴定管,溶液也不得溅出。
⑵ 滴定时,左手不能离开活塞任其自流。⑶ 注意观察溶液落点周围溶液颜色的变化。
⑷ 开始时,应边摇边滴,滴定速度可稍快,但不能流成“水线”。接近终点时,应改为加一滴,摇几下。
最后,每加半滴溶液就摇动锥形瓶,直至溶液出现明显的颜色变化。加半滴溶液的方法如下:微微转动活塞,使溶液悬挂在出口管嘴上,形成半滴,用锥形瓶内壁将其沾落,再用洗瓶以少量蒸馏水吹洗瓶壁。
用碱管滴加半滴溶液时,应先松开拇指和食指,将悬挂的半滴溶液沾在锥形瓶内壁上,再放开无名指与小指。这样可以避免出口管尖出现气泡,使读数造成误差。
⑸ 每次滴定最好都从0.00开始(或从零附近的某一固定刻度线开始),这样可以减小误差。(6)滴定结束后,滴定管内剩余的溶液应弃去,不得将其倒回原瓶,以免沾污整瓶操作溶液。
随即洗净滴定管,并用蒸馏水充满全管,备用。装满或放出溶液后,必须等1~2分钟,使附着在内壁的溶液流下来,再进行读数。
如果放出溶液的速度较慢(例如,滴定到最后阶段,每次只加半滴溶液时),等0.5~1分钟即可读数。每次读数前要检查一下管壁是否挂水珠,管尖是否有气泡。
必须读到小数点后第二位,即要求估计到0.01mL。注意,估计读数时,应该考虑到刻度线本身的宽度。
读取初读数前,应将管尖悬挂着的溶液除去。滴定至终点时应立即关闭活塞,并注意不要使滴定管中的溶液有稍许流出,否则终读数便包括流出的半滴液。
因此,在读取终读数前,应注意检查出口管尖是否悬挂溶液,如有,则此次读数不能取用。以上参考来源百度百科 高中范围内常见滴定:酸碱中和滴定、氧还原滴定(碘量法)、草酸-高锰酸钾滴定、沉淀滴定(BaSO4-AgCl);其中碘量法滴定要在磨口锥形瓶中操作(碘量瓶)。
4.滴定的操作步骤是什么
进行滴定时,应将滴定管垂直地夹在滴定管架上。
如使用的是酸管,左手无名指和小手指向手心弯曲,轻轻地贴着出口管,用其余三指控制活塞的转动。但应注意不要向外拉活塞以免推出活塞造成漏水;也不要过分往里扣,以免造成活塞转动困难,不能操作自如。
如使用的是碱管,左手无名指及小手指夹住出口管,拇指与食指在玻璃珠所在部位往一旁(左右均可)捏乳胶管,使溶液从玻璃珠旁空隙处流出。 注意:①不要用力捏玻璃珠,也不能使玻璃珠上下移动;②不要捏到玻璃珠下部的乳胶管;③停止滴定时,应先松开拇指和食指,最后再松开无名指和小指。
无论使用哪种滴定管,都必须掌握下面三种加液方法:①逐滴连续滴加;②只加一滴;③使液滴悬而未落,即加半滴。 滴定操作中应注意以下几点:⑴摇瓶时,应使溶液向同一方向作圆周运动(左右旋转均可),但勿使瓶口接触滴定管,溶液也不得溅出。
⑵滴定时,左手不能离开活塞任其自流。⑶注意观察溶液落点周围溶液颜色的变化。
⑷开始时,应边摇边滴,滴定速度可稍快,但不能流成“水线”。 接近终点时,应改为加一滴,摇几下。
最后,每加半滴溶液就摇动锥形瓶,直至溶液出现明显的颜色变化。加半滴溶液的方法如下:微微转动活塞,使溶液悬挂在出口管嘴上,形成半滴,用锥形瓶内壁将其沾落,再用洗瓶以少量蒸馏水吹洗瓶壁。
用碱管滴加半滴溶液时,应先松开拇指和食指,将悬挂的半滴溶液沾在锥形瓶内壁上,再放开无名指与小指。 这样可以避免出口管尖出现气泡,使读数造成误差。
⑸每次滴定最好都从0。00开始(或从零附近的某一固定刻度线开始),这样可以减小误差。
(6)滴定结束后,滴定管内剩余的溶液应弃去,不得将其倒回原瓶,以免沾污整瓶操作溶液。随即洗净滴定管,并用蒸馏水充满全管,备用。
相关推荐
声明:本网站尊重并保护知识产权,根据《信息网络传播权保护条例》,如果我们转载的作品侵犯了您的权利,请在一个月内通知我们,我们会及时删除。
蜀ICP备2020033479号-4 Copyright © 2016 学习鸟. 页面生成时间:2.913秒









