高中钠铝(高一有关钠都需要掌握哪些内容)
1.高一有关钠都需要掌握哪些内容
《碱金属》精彩视点 一、钠1.钠在空气中的系列变化:2.钠与水反应及拓展 ⑴钠与水激烈反应,放出氢气并生成氢氧化钠,水中加酚酞,溶液呈红色。
⑵钠与酸反应:2Na+2H+=2Na++H2↑,钠不足时,直接与酸反应;钠过量时,先与酸反应,再与水反应。⑶与盐反应:①在水溶液中,钠先与水反应,生成的碱再与盐发生复分解反应:Na与CuSO4溶液反应:2Na+2H2O+CuSO4=Cu(OH)2↓+H2↑+Na2SO4 ②在熔融状态时,钠直接与盐发生置换反应:4Na+TiCl4 Ti+4NaCl 二、碳酸钠和碳酸氢钠1.Na2CO3与盐酸的互滴反应 ⑴向盐酸里逐滴加入Na2CO3溶液(开始时酸过量),一滴入就有气体放出:Na2CO3+2HCl=2NaCl+CO2↑+H2O ⑵向Na2CO3溶液里逐滴加入盐酸(开始时酸不足),开始时无气体放出:Na2CO3+HCl=NaCl+NaHCO3(无气泡),NaHCO3+HCl=NaCl+H2O+CO2↑ 不同的滴加顺序产生不同的现象,这是不用其他试剂鉴别Na2CO3与盐酸的原理。
2.Na2CO3、NaHCO3与Ca(OH)2的反应 ⑴碳酸钠溶液与石灰水混合:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ⑵少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O 过量的NaHCO3与Ca(OH)2反应:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O3.Na2CO3与NaHCO3的鉴别方法 ⑴晶体受热:NaHCO3受热产生使澄清石灰水变浑浊的无色无味气体CO2,Na2CO3无此性质:2NaHCO3 Na2CO3+CO2↑+H2O ⑵CaCl2溶液:CaCl2溶液滴加到Na2CO3溶液中能产生白色沉淀,滴加到NaHCO3溶液中无白色沉淀:CaCl2+Na2CO3=CaCO3↓+2NaCl ⑶用稀盐酸:向Na2CO3溶液中逐滴加入稀盐酸,开始一段时间无气体产生,当盐酸滴加到一定量后有气体产生。而向NaHCO3溶液中滴加稀盐酸,立即产生无色无味的气体。
三、过氧化钠1.强氧化性:Na2O2与还原性物质反应时表现出强氧化性:Na2O2与FeCl2反应:4Na2O2+6H2O+4FeCl2=8NaCl+4Fe(OH)3↓+O2↑2.还原性:Na2O2与强氧化剂酸性高锰酸钾反应时表现出还原性:Na2O2与酸性高锰酸钾反应:5Na2O2+8H2SO4+2KMnO4=K2SO4+5Na2SO4+2MnSO4+5O2+8H2O3.氧化性与还原性:Na2O2与CO2、H2O、HCl、NH4Cl等反应时,既表现氧化性又表现还原性,Na2O2不是碱性氧化物。Na2O2与H2O反应:2Na2O2+2H2O=4NaOH+O2↑ Na2O2与CO2反应:2Na2O2+2CO2=2Na2CO3+O2↑ Na2O2与HCl反应:2Na2O2+4HCl=4NaCl+O2↑+2H2O Na2O2与NH4Cl反应:2Na2O2+4NH4Cl=4NaCl+O2↑+4NH3↑4.漂白性:Na2O2能使有机色质品红溶液、酚酞试液等褪色,表现出漂白性。
四、氢氧化钠1.俗名:烧碱、火碱、苛性钠2.物理性质:白色固体,易潮解,易溶于水放热,有强腐蚀性。3.化学性质:一元强碱,有碱的通性,易与酸反应,与酸性氧化物反应。
4.保存和称取:密封保存,试剂瓶应用橡皮塞;称取时,应用小烧杯或表面皿等仪器,且快速称量,不能用纸。五、碱金属中的一般规律与特例1.钾、钠在常温下是固体,但钾、钠合金在常温下为液态。
2.酸式盐的溶解度一般大于正盐,但溶解度NaHCO3<Na2CO3。3.氧在化合物中一般显–2价,氢显+1价,但Na2O2、H2O2中的氧显–1价,NaH、CaH2中的氢显–1价。
4.试剂瓶中的药品取出后,一般不能放回原瓶,金属Na、K等除外。5.碱金属单质一般跟水剧烈反应,但锂跟水反应缓慢(氢氧化锂的溶解度小)。
六、焰色反应1.焰色反应是元素的物理性质,金属离子或金属原子均能发生焰色反应。2.不是所有元素都有特殊的焰色,只有碱金属元素及铜、钙等少数金属才能呈现焰色反应。
3.焰色反应与气体物质燃烧时产生的各色火焰有本质的区别。焰色反应是它们的原子或离子的外围电子被激发跃迁而产生各种颜色光的过程。
《碱金属》考点回放 考点1:钠的性质 例1:下列有关钠的叙述中,错误的是 A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等 B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 C.钠是一种灰黑色的固体 D.钠的质地软,可用小刀切割 解法指导:钠是银白色金属,质软易切割;化学性质活泼,具有很强的还原性,易与空气中的氧气、水反应,在自然界中只能以化合态存在。答案:C 同步练习1:有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物是什么。
⑴当进行适当操作时还需要的仪器有____________。⑵如何进行操作?_______________。
参考答案:⑴小试管和酒精灯。⑵将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口移近酒精灯,松开拇指点燃试管中的气体。
考点2:过氧化钠的性质 例2:取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag。下列物质中不能满足上述结果的是 A.CO B.H2 C.C6H12O6 D.C12H22O11 解法指导:CO在O2完全燃烧,产物与Na2O2完全反应:①2CO+O2=2CO2②2Na2O2+2CO2=Na2CO3+O2↑ ①+②加合约简得:CO+Na2O2=Na2CO3,Na2O2增加的质量是。
2.人教版高中化学必修一钠铝铁
Na及其化合物 (一)Na 1、物性:银白色质软金属;密度:0.97g·cm-1;熔点:97.8。
C 2、化性:强还原性 (1)能被绝大多数非金属氧化(甚至被H2氧化生成NaH) 4Na + O2 = 2Na2O(白色固体) ;2Na + O2 = Na2O2(淡黄色固体) Na露置于空气中:银白→变暗→变白→表面溶液→白色晶体→白色粉末 Na→NaO→NaOH→吸水→Na2CO3·10H2O→风化 (2)与水:2Na+2H2O= 2NaOH+ H2↑ 现象及解释: (3)与酸:先与H+反应放H2,H+耗完后再与水反应放H2。 (4)与盐溶液:先与水反应,生成NaOH如果能与盐发生复分解则继续。
不置换金属。 例:Na投入CuSO4溶液中: 2Na+2H2O= 2NaOH+ H2↑; CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 (5)与碱溶液:Na与其中的水反应,增大碱的浓度。
(二)Na的氧化物:Na2O和Na2O2 1、Na2O:碱性氧化物,具有碱性氧化物的通性。如:Na2O+ 2HCl = 2NaCl+ H2O 2、Na2O2:过氧化物,不是碱性氧化物。
既有氧化性,又有还原性。 (1)自身氧化还原:2Na2O2+2H2O=4NaOH+ O2↑; 2Na2O2+2CO2= 2Na2CO3+ O2 (2)漂白(氧化性漂白):其投入含酚酞的水中:有气泡产生,溶液先变红,后退色。
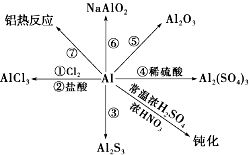
Al及其化合物: (一)Al的化性:较强还原性 1、与非金属:常温下,与O2生成Al2O3保护膜。 2、与酸:(1)非氧化性酸:2Al+ 6H+(强酸)=2Al3++3 H2↑ (2)氧化性酸:浓H2SO4、HNO3等 常温下,Al遇浓H2SO4、浓HNO3钝化;加热仍可反应。
3、金属间置换——铝热反应 2Al+ Fe2O3 = 2 Fe + Al2O3 + 热 (与Al后的金属氧化物高温下置换) 4、与碱溶液:2Al + 6H2O + 2NaOH = 2Na〔Al(OH)4〕+3 H2↑ (二)Al2O3:白色固体,不溶于水;两性氧化物。 1、与酸:Al2O3 + 6H+(强酸)=2Al3++3 H2O 2、与碱:Al2O3+ 3H2O + 2NaOH = 2Na〔Al(OH)4〕(三)Al(OH)3:白色胶状物,不溶于水;两性氢氧化物(只与强酸、强碱反应)。
1、与酸:Al(OH)3 + 3H+(强酸)=Al3++3 H2O 2、与碱:Al(OH)3+ NaOH = Na〔Al(OH)4〕 3、受热分解:2Al(OH)3 = Al2O3+ 3H2O (四)Al3+盐: 1、Al3+盐溶液中逐滴滴加NaOH至过量:先沉淀,后溶解。 Al3++3OH- = Al(OH)3↓ ;Al(OH)3 + OH-= 〔Al(OH)4〕- 2、Al3+盐溶液逐滴滴加NH3 ·H2O至过量:生成稳定的沉淀 Al3+ + 3NH3 ·H2O = Al(OH)3↓+ 3NH4+ Fe及其化合物 (一)Fe的化性:变价金属,被强氧化剂氧化为 Fe3+;被弱氧化剂氧化为Fe2+。
1、Cl2、Br2、HNO3、浓H2SO4等将Fe氧化为Fe3+。 2、I2、S、H+、Cu2+等将Fe氧化为Fe2+。
3、3Fe + 2O2 = Fe3O4 4、3Fe + 4H2O = Fe3O4 + 4H2(高温条件) (二)Fe的氧化物:FeO、Fe2O3、Fe3O4 1、物性:FeO黑色固体、Fe2O3红棕色固体、Fe3O4黑色晶体;三者均不溶于水。 2、化性:FeO 、Fe2O3为碱性氧化物,对应的碱分别是:Fe(OH)2 、Fe(OH)3 (三)Fe的氢氧化物:Fe(OH)2 、Fe(OH)3: 1、物性:Fe(OH)2白色胶状物,不溶于水;Fe(OH)3红褐色固体,不溶于水。
2、化性:不溶性碱(离子方程式中不拆) Fe(OH)2易被氧化,在空气中白色沉淀迅速变成灰绿色,最终变成红褐色。 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (四)Fe2+和Fe3+的盐: 1、Fe2+的盐:既有氧化性(弱),又有还原性(强) (1)氧化性:3Fe2+ + 2Al= 3Fe + 2Al3+ (2)还原性:Fe2+的盐可被Cl2、Br2、HNO3等氧化为Fe3+,溶液由浅绿变棕黄色。
例:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 2、Fe3+的盐:只有氧化性,遇Fe、Cu、I-、SO2(SO32-)等,本身被还原为Fe2+,相应还原剂被氧化为:Fe2+、Cu2+、I2、H2SO4(或SO42-) 例:2Fe3+ + Fe = 3Fe2+;2Fe3+ + Cu= 2Fe2+ + Cu2+;2Fe3+ + 2I- = 2Fe2+ + I2 3、Fe2+和Fe3+盐的检验: (1)加碱: (2)KSCN或NH4SCN溶液:Fe2+盐溶液无现象;Fe3+盐溶液变血红色(溶液) Fe3+ + 6SCN- = [Fe(SCN)6]- 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 氯气与金属钠反应:2Na + Cl2 点燃 2NaCl 氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 7钠在空气中燃烧:2Na + O2 =△ Na2O2 钠与氧气反应:4Na + O2 = 2Na2O 过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2 钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O SO2 + Na2O = NaSO3 SO2 + 2NaOH = Na2SO3 + H2O NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O2Na + S =(研磨)Na2S 3S +6NaOH = 2Na2S + Na2SO3 +3H2O 铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 氧化铝与氢。
3.高中化学有关Na的全部知识点
1.Na投入水中:
现象:浮在水面上、熔成小球、四处游动、并发出嘶嘶的响声(简称:浮、球、游、鸣)
性质:浮:证明钠的密度比水小
球:证明钠的熔点低
游:证明有气全放出,并推动小球四处游动
鸣:是气体排空的声音
反应:2Na+2H2O=2NaOH+H2
2.钠燃烧火焰呈淡蓝色,生成淡黄色固体:Na2O2
3.钠投入CuSO4液的变化:有气体放出,并生成蓝色沉淀
方程式如下:2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2+H2
4.工业制金属钠:2NaCl=2Na+Cl2(电解熔融氯化钠)
5.等量Mg.Al.Na与足量盐酸反应,产生H2最多的是:
若是等物质的量:产生氢气最多的是:AL
若是等质量:产生氢氢最多的也是AL
6钠的性质钠属于第三周期第一族元素,电荷数为一,所以它比较活泼。钠属于金属元素,在未氧化前是银白色的,但是只要暴露在空气中很短的时间即可被氧化成黑色。还有记得当时老师给我们做实验时是用小刀切给我们每人一小块,一般的金属我们用小刀切不动的,这可以说明钠的质地比较软,当然它也是固体了,不然还怎么切呢。钠还有焰色反应,一般是显黄颜色的。钠的化学性质主要是由于它核外电子数为一,处于第三周期决定的,它相对同一族的锂来谁比较活泼,但是相对同族的钾、铷、铯来说,它就不铷它们活泼了,钠很容易与氧气反应,被氧化;钠还很用与水反应,发出滋滋的声音并且水面冒气泡,这是由于它和水反应放出很多热量,并且产生氢气的原因。由于这两个性质,钠经常是保存在煤油中,只有在使用时临时从煤油中取出。
4.高中 金属钠的所有知识点是什么
电解氯化钠制金属钠通常在电解槽里进行。
电解时氯化钠需要熔融,氯化钠的熔点为801℃,在技术上有困难。用熔融温度约为580℃的质量分数为40%氯化钠和60%氯化钙的低共熔物(即两种或两种以上物质形成的熔点最低的混合物),降低了电解时所需的温度,从而也减低了钠的蒸气压。
电解时,氯气在阳极放出,当电流通过熔盐时,金属钠和金属钙同时被还原出来,浮在阴极上方的熔盐上面,从管道溢出。把熔融的金属混合物冷却到(105~110)℃,金属钙成晶体析出,经过滤就可以把金属钠跟金属钙分离。
4Na+O2====Na2O 2Na+O2====Na2O2 2Na+Cl2====2NaCl(常温下也反应) 2Na+S====Na2S(可能爆炸) 2Na+2H2O====2NaOH+H2↑ 2Na+2HCl====2NaCl+H2↑ 2NaOH+CuSO4====Na2SO4+Cu(OH)2 4Na+TiCl4====Ti+4NaCl Na2O+。电解氯化钠制金属钠通常在电解槽里进行。
电解时氯化钠需要熔融,氯化钠的熔点为801℃,在技术上有困难。用熔融温度约为580℃的质量分数为40%氯化钠和60%氯化钙的低共熔物(即两种或两种以上物质形成的熔点最低的混合物),降低了电解时所需的温度,从而也减低了钠的蒸气压。
电解时,氯气在阳极放出,当电流通过熔盐时,金属钠和金属钙同时被还原出来,浮在阴极上方的熔盐上面,从管道溢出。把熔融的金属混合物冷却到(105~110)℃,金属钙成晶体析出,经过滤就可以把金属钠跟金属钙分离。
4Na+O2====Na2O 2Na+O2====Na2O2 2Na+Cl2====2NaCl(常温下也反应) 2Na+S====Na2S(可能爆炸) 2Na+2H2O====2NaOH+H2↑ 2Na+2HCl====2NaCl+H2↑ 2NaOH+CuSO4====Na2SO4+Cu(OH)2 4Na+TiCl4====Ti+4NaCl Na2O+H2O====2NaOH Na2O+2HCl====2NaCl+H2O Na2O+CO2====Na2CO3 2Na2O2+2H2O====4NaOH+O2 2Na2O2+2CO2====2Na2CO3+O2 Ca(OH)2+CO2(少量)====CaCO3↓+H2O Ca(OH)2+2CO2(过量)====Ca(HCO3)2 CaCO3+CO2+H2O====Ca(HCO3)2 2NaOH+CO2(少量)====Na2CO3+H2O NaOH+CO2(过量)====NaHCO3 Na2CO3+H2O+CO2====2NaHCO3 Na2CO3+2HCl====H2O+CO2+2NaCl NaHCO3+HCl====H2O+CO2+NaCl Na2CO3+Ca(OH)2====2NaOH+CaCO3↓ Na2CO3+CaCl2====CaCO3↓+2NaCl NaHCO3+NaOH====Na2CO3+H2O 2NaHCO3+Ca(OH)2(少量)====Na2CO3+CaCO3↓+H2O NaHCO3+Ca(OH)2(过量)====NaOH+CaCO3↓+H2O 2NaHCO3====Na2CO3+H2O+CO2 1、钠在空气中放置 4Na + O2 = 2 Na2O 2、钠在空气中点燃 2Na +O2 ===== Na2O2 3、钠和硫反应 2Na + S =Na2S 4、钠和水反应 2Na + 2H2O =2NaOH +H2↑ 5、钠和硫酸铜溶液反应 2Na + CuSO4 + 2H2O = Cu(OH)2 ↓+Na2SO4 +H2 ↑ 6、钠和乙醇反应 2Na + 2CH3CH2OH = 2CH3CH2ONa +H2↑ 7、氧化钠和水反应 Na2O + H2O = 2NaOH 8、氧化钠和二氧化碳反应 Na2O + CO2 = Na2CO3 9、氧化钠和盐酸反应 Na2O + 2HCl = 2NaCl + H2O 10、过氧化钠和水反应 2Na2O2 + 2H2O = 4NaOH + O2↑ 11、过氧化钠和二氧化碳反应 2Na2O2 + 2CO2 = 2Na2CO3 + O2 12、过氧化钠和盐酸反应 2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑ 13、碳酸氢钠受热分解 2NaHCO3 △ Na2CO3 + CO2↑+ H2O 14、碳酸钠和盐酸反应 Na2CO3 +2HCl = 2NaCl + CO2↑ +H2O Na2CO3 +HCl = NaCl + NaHCO3 15、碳酸氢钠和盐酸反应NaHCO3 +HCl = NaCl + CO2↑ +H2O 16、碳酸钠和氢氧化钙反应Na2CO3 +Ca(OH)2 = CaCO3 ↓+ 2NaOH 17、碳酸氢钠和氢氧化钠反应 NaHCO3 + NaOH = Na2CO3 + H2O 18、碳酸氢钠和氢氧化钙反应 2NaHCO3 + Ca(OH)2 = CaCO3↓+ Na2CO3 + 2H2O NaHCO3 + Ca(OH)2 = CaCO3↓+ NaOH + H2O。
5.高中化学基础
物理性质:钠单质很软,可以用小刀切割。
切开外皮后,可以看到钠具有银白色的金属光泽,很快就会被氧化失去光泽。钠是热和电的良导体,钾钠合金(液态)是原子堆导热剂。
钠的密度是0.97g/cm3,比水的密度小,比煤油密度大,钠的熔点是97.81℃,沸点是882.9℃。钠单质还具有良好的延展性,硬度也低。
化学性质:钠原子的最外层只有1个电子,很容易失去,所以有强还原性。因此,钠的化学性质非常活泼,在与其他物质发生氧化还原反应时,作还原剂,都是由0价升为 1价。
金属性强。其离子氧化性弱。
跟氧气的反应 在常温时:4Na+O2=2Na2O (白色粉末) 在点燃时:2Na+O2=△=Na2O2 (淡黄色粉末) ★钠在空气中点燃时,迅速熔化为一个闪亮的小球,发出黄色火焰,生成过氧化钠(Na2O2)和少量超氧化钠(Na2O4)。过氧化钠比氧化钠稳定,氧化钠可以和氧气化合成为过氧化钠,化学方程式为:2Na2O O2=2Na2O22.钠能跟卤素、硫、磷、氢等非金属直接发生反应,生成相应的化合物(以下反应常温下均反应),如2Na Cl2=2NaCl (放出大量热,生成大量白烟)2Na+S=Na2S(硫化钠)(钠与硫研磨会发生爆炸)2Na Br2=2NaBr(溴化钠)(溴化钠可以用作镇静剂) 跟水的反应 在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中。
为了安全应在烧杯上加盖玻璃片。观察到的现象及由现象得出的结论有:1、钠浮在水面上(钠的密度比水小) 2、钠熔成一个闪亮的小球(钠与水反应放出热量,钠的熔点低)3、钠在水面上四处游动(有气体生成)4、发出嘶嘶的响声(生成了气体,反应剧烈)5、事先滴有酚酞试液的水变红(有碱生成) 反应方程式2Na+2H2O=2NaOH+H2↑ ★钠由于此反应剧烈,能引起氢气燃烧,所以钠失火不能用水扑救,必须用干燥沙土来灭火。
钠具有很强的还原性,可以从一些熔融的金属卤化物中把金属置换出来。由于钠极易与水反应,所以不能用钠把居于金属活动性顺序钠之后的金属从其盐溶液中置换出来。
与酸溶液反应 钠与水反应本质是和水中氢离子的反应,所以钠与盐酸反应,不是先和水反应 钠与酸溶液的反应涉及到钠的量,如果钠少量,只能与酸反应,如钠与盐酸的反应:2Na 2HCl=2NaCl H2↑ 如果钠过量,则优先与酸反应,然后再与酸溶液中的水反应,方程式见3 与盐反应 (1)与盐溶液反应 将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应。如将钠投入硫酸铜溶液中:2Na+2H2O=2NaOH+H2↑2NaOH CuSO4=Na2SO4 Cu(OH)2↓ (2)与熔融盐反应 这类反应多数为置换反应,常见于金属冶炼工业中,如4Na TiCl4==熔融==4NaCl Ti(条件为高温且需要氩气做保护气) Na KCl=K NaCl(条件为高温) ★钠与熔融盐反应不能证明金属活动性的强弱 与有机物反应 钠还能与某些有机物反应,如钠与乙醇反应:2Na 2C2H5OH→2CH3CH2ONa H2↑(生成物为氢气和乙醇钠) 有关化学方程式 ⑴与非金属单质: 2Na+H2=高温=2NaH4Na+O2=2Na2O (白色固体)2Na+O2=点燃=Na2O2 (淡黄色粉末) ⑵与金属单质反应4Na 9Pb=加热=Na4Pb9 Na Tl=加热=NaTl ⑶与水: 2Na+2H2O=2NaOH+H2↑ ⑷与酸: 2Na 2HCl=2NaCl H2↑ ⑸与碱; 不反应(与碱溶液反应) ⑹与盐; ①4Na TiCl4=高温=4NaCl Ti6Na 2NaNo2=高温=N2↑ 4Na2O Na KCl=高温=K↑ NaCl ②2Na+2H2O=2NaOH+H2↑2NaOH CuSO4=Na2SO4 Cu(OH)2↓ 或2Na+2H2O=2NaOH+H2↑ NH4Cl NaOH=NaCl NH3↑+H2O ⑺与氧化物: 4Na CO2=点燃=2Na2O C↓ 钠的制取与保存 制取 通过电解熔融的氯化钠(食盐)或熔融氢氧化钠制得。
反应方程式:熔融状态下,2NaCl(电解)=2Na Cl2↑ (当斯法)2NaOH(电解)=2Na O2↑ H2↑ (卡斯纳法) 保存 钠的化学性质很活泼,所以它在自然界里不能以游离态存在,因此,在实验室中通常将钠保存在煤油或石蜡油里。(原因:ρ Na>ρ煤油且Na与煤油不发生化学反应)。
6.高一化学钠化合物的知识总结
钠及其化合物的性质: 1. 钠在空气中缓慢氧化:4Na+O2==2Na2O 2. 钠在空气中燃烧:2Na+O2点燃====Na2O2 3. 钠与水反应:2Na+2H2O=2NaOH+H2↑ 现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
4. 过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑ 5. 过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2 6. 碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑ 7. 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O 8. 在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO3 铁及其化合物性质 1. Fe2+及Fe3+离子的检验: ① Fe2+的检验:(浅绿色溶液) a) 加氢氧化钠溶液,产生白色沉淀,继而变灰绿色,最后变红褐色。 b) 加KSCN溶液,不显红色,再滴加氯水,溶液显红色。
② Fe3+的检验:(黄色溶液) a) 加氢氧化钠溶液,产生红褐色沉淀。 b) 加KSCN溶液,溶液显红色。
2. 主要反应的化学方程式: ① 铁与盐酸的反应:Fe+2HCl=FeCl2+H2↑ ② 铁与硫酸铜反应(湿法炼铜):Fe+CuSO4=FeSO4+Cu ③ 在氯化亚铁溶液中滴加氯水:(除去氯化铁中的氯化亚铁杂质)3FeCl2+Cl2=2FeCl3 ④ 氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ⑤ 在氯化铁溶液中加入铁粉:2FeCl3+Fe=3FeCl2 ⑥ 铜与氯化铁反应(用氯化铁腐蚀铜电路板):2FeCl3+Cu=2FeCl2+CuCl2 ⑦ 少量锌与氯化铁反应:Zn+2FeCl3=2FeCl2+ZnCl2 ⑧ 足量锌与氯化铁反应:3Zn+2FeCl3=2Fe+3ZnCl2 铝及其化合物的性质 1. 铝与盐酸的反应:2Al+6HCl=2AlCl3+3H2↑ 2. 铝与强碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ 3. 铝在空气中氧化:4Al+3O2==2Al2O3 4. 氧化铝与酸反应:Al2O3+6HCl=2AlCl3+3H2O 5. 氧化铝与强碱反应:Al2O3+2NaOH+3H2O=2Na[Al(OH)4] 6. 氢氧化铝与强酸反应:Al(OH)3+3HCl=AlCl3+3H2O 7. 氢氧化铝与强碱反应:Al(OH)3+NaOH=Na[Al(OH)4] 8. 实验室制取氢氧化铝沉淀:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ 钠及其化合物的性质: 1. 钠在空气中缓慢氧化:4Na+O2==2Na2O 2. 钠在空气中燃烧:2Na+O2点燃====Na2O2 3. 钠与水反应:2Na+2H2O=2NaOH+H2↑ 现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。 4. 过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑ 5. 过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2 6. 碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑ 7. 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O 8. 在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaH 铁及其化合物性质 1. Fe2+及Fe3+离子的检验: ① Fe2+的检验:(浅绿色溶液) a) 加氢氧化钠溶液,产生白色沉淀,继而变灰绿色,最后变红褐色。
b) 加KSCN溶液,不显红色,再滴加氯水,溶液显红色。 ② Fe3+的检验:(黄色溶液) a) 加氢氧化钠溶液,产生红褐色沉淀。
b) 加KSCN溶液,溶液显红色。 2. 主要反应的化学方程式: ① 铁与盐酸的反应:Fe+2HCl=FeCl2+H2↑ ② 铁与硫酸铜反应(湿法炼铜):Fe+CuSO4=FeSO4+Cu ③ 在氯化亚铁溶液中滴加氯水:(除去氯化铁中的氯化亚铁杂质)3FeCl2+Cl2=2FeCl3 ④ 氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ⑤ 在氯化铁溶液中加入铁粉:2FeCl3+Fe=3FeCl2 ⑥ 铜与氯化铁反应(用氯化铁腐蚀铜电路板):2FeCl3+Cu=2FeCl2+CuCl2 ⑦ 少量锌与氯化铁反应:Zn+2FeCl3=2FeCl2+ZnCl2 ⑧ 足量锌与氯化铁反应:3Zn+2FeCl3=2Fe+3ZnCl2。
相关推荐
声明:本网站尊重并保护知识产权,根据《信息网络传播权保护条例》,如果我们转载的作品侵犯了您的权利,请在一个月内通知我们,我们会及时删除。
蜀ICP备2020033479号-4 Copyright © 2016 学习鸟. 页面生成时间:3.272秒









