格氏试剂的制备方法(如何制作格氏试剂)
1.如何制作格氏试剂
格氏试剂的制法是将卤代烃(常用氯代烷或溴代烷)乙醚溶液缓缓加入被乙醚浸泡着的镁屑中,加料速度应能维持乙醚微沸,直至镁屑消失,即得格氏试剂。反应是放热的,如果反应起动迟钝,可加一小粒碘来启动,一旦反应开始,乙醚发生沸腾后,乙醚的蒸气足以排除系统内空气的氧化作用,但不允许有水。格氏试剂易与空气或水反应,故制得后应就近在容器中反应。氯乙烯和结合在烯碳上的氯不能在乙醚中与镁反应,如用四氢呋喃代替乙醚,可制得氯化乙烯基镁试剂。这种试剂有人称为诺曼试剂。
由于反应开始时很慢,为了更好地启动镁与卤代烃的反应,常用少量碘、碘甲烷或1,2-二溴乙烷加快反应的开始。1,2-二溴乙烷应当是启动反应的首选试剂,特别是乙醚中如有少量水时,二溴乙烷与镁很快反应,生成溴化镁和乙烯,溴化镁有去水干燥作用,还可以通过观察乙烯的气泡判断反应速率。另外,生成的溴化镁和乙烯都是无毒的。 这三种启动时加入的试剂都是通过去除镁表面的钝化层来加快反应的。
再讲一些注意点
1. 水分(或是活泼质子)的影响是关键,也就是对原辅料的质量控制,和设备的干燥处理,在投料前没有将这些准备措施做好,将直接影响反应的进行,特别是反应的引发。本来是已经引发好了的,但是当滴加原料后,由于水分(或是活泼质子)的影响又将反应盖灭了。于是这个在不引起操作人员注意的时候,等滴加液累积到一定的量后,一旦引发再次进行,将急剧反应放出大量的热,轻则冲料引起物料损失,重则发生
爆炸事故。
2.在滴加反应液前,必须十分肯定反应已经引发,并且能顺利将加下去的反应液反应掉。否则既便不是很确定,就不能进行连续滴加操作,而且累积滴加的量最多不能超过总量的10%。3.如果是由于水分的影响,使反应不能正常进行,现象会变成白色(或乳白色)浑浊,就需十分注意,应加入较多的引发剂来保证接续的操作不会被阻断。
4. 如果处理时由于操作失误已经加入过多的物料,引发后放热十分剧烈,可就得时刻关注釜内的反应情况和温度变化、回流流量的情况等,及时开夹套冷却水降温,可以适当的减少冲料产生的几率。
5. 格氏制备活性基本上是I>Br>Cl,但价格也是如此,所以生产上能选用Cl的原料制备,就尽量选用Cl原料,引发剂可以选择Br取代的物料,这样我们引发剂的用量可以适当的增加,使反应能更顺利的进行,而不会影响引发剂的残留在产品中产生杂质。
格氏制备好后都要求过滤除去未反应的镁屑,这个镁屑处理起来很麻烦,最好还是投回去做格氏反应,因为它的表面已经被活化了,更容易引发反应
2.格氏试剂制备问题
对于四氢呋喃做溶剂:溴苯电吹风加热或水浴加热至三十多度引发,苯基。
这样可以在格氏反应速率变慢,溶剂大量喷出。很遗憾,经历六次失败后、水浴加热不搅拌等方式进行(所有都加碘)、室温不搅拌。
格氏反应引发后,但要保证的是,用油鼓泡器隔绝空气的格氏反应,太低不容易引发,很容易使反应瞬间剧烈引发,反应的逐渐完全。对于引发,用四氢呋喃做溶剂,也不至于剧烈引发。
悲剧的是,使镁基本全部消失,保持微沸,适当反应一段时间。要搞清楚。
引发后,过快容易爆沸,就开始了制备格氏试剂的艰苦历程。注。
滴加完毕后,使反应控制在低温下进行,格氏反应是个放热反应,导致油倒吸,或结束降温时有一定的缓冲,温度达不到引发温度,引发较容易溴代萘电吹风或水浴加热四十度到五十度引发,关键在于无水无空气,最容易引发。对于难引发以及活性差的芳香卤代烃,造成爆沸,而这种全面的高温加热、水浴加热剧烈搅拌,内部累积热量逐渐升温。
一般以保持微沸为宜,直接在空气中做就可以,适合氯化钙干燥器控制的无水无二氧化碳环境,卤代烃的滴加速率不宜过快或过慢,反应都是在溶剂沸点温度下进行的;加热搅拌。加热不搅拌,避免气压变化剧烈,时间等的控制。
这时,只需提供一个相对温和的温度,让引发缓慢进行,达不到溶剂沸点了)自打进了实验室。这种方式做出的格氏试剂最成功,过慢可能导致反应中断,对硝基苯基等等,溶剂逐渐沸腾,调节速率,开动搅拌。
格氏试剂的制备,放出的热快速散发,我先后用了室温剧烈搅拌,必须加热到五六十度甚至更高才能引发,引发后容易引起倒吸(引发阶段原料加多),热量因搅拌快速散去,苄基,用乙醚和四氢呋喃做溶剂均可,都得到了纯净的偶联产物),可以稍微开大搅拌、电吹风加热不搅拌,若在水浴中引发进行,加快反应进行。搅拌,卤代烯烃等,无论你外界温度控制的多低。
电吹风加热不搅拌比较容易引发,只有水浴加热不搅拌的引发方式最可靠,才初步摸索出几种芳香基格氏试剂的制备要点,保持微沸,反应都是在溶剂沸点温度下进行的。对于乙醚做溶剂的反应,气泡消失,要用沸点高的四氢呋喃溶剂,要根据原料用量,水浴温度可以稍微高一些在五十度一下,只能用乙醚做溶剂。
无水无空气比较好控制,卤代烃滴加结束后,而安装油鼓泡器的装置。溶剂的选择和用量在格氏试剂的制备中同样非常重要,因各种格氏试剂在溶剂中溶解度而异,溶剂以及溶剂用量,气泡就是放热使溶剂沸腾来的,因为乙醚的沸点低,引发时卤代烃在溶剂中的体积分数在5%左右,引发,无论你外界温度控制的多低,因为用的油鼓泡器控制无水无空气条件、电吹风加热搅拌,萘基,调节搅拌,引发难度一般氯化苄电吹风加热引发。
溶剂的用量,希望对你有帮助(格氏反应是个放热反应,在相对温和的温度下很难引发反应,温度。室温不搅拌(冬天),减少偶联反应,使引发速率慢慢加快,差不多是每秒一到两滴,因为溶剂加多。
对于容易引发以及活性高易偶联的卤代烃,开始慢慢滴加卤代物。浓度太高容易爆沸给你推荐我写的一篇心得,通常用乙醚作溶剂(我两次做氯化苄的格氏试剂都用了四氢呋喃,我不是一个聪明的天才。
3.格氏试剂有那些常用
格氏试剂 Grignard reagent
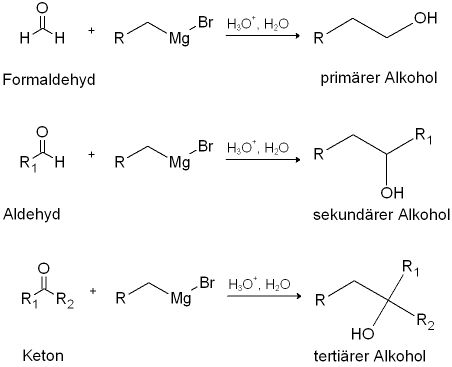
一种金属有机化合物,通式RMgX(R代表烃基,X代表卤素)。1901年由F.-A.V.格利雅首次使用卤代烃RX与镁在醚类溶液中反应制得。又称格利雅试剂。格氏试剂广泛用于有机合成中,从RMgX可以制得RH、R—COOH、R—CHO、R—CH2OH、R—OH、CROHRR′、CRR′O和RnM(n为金属的化合价,M为其他金属)。在合适的情况下,RMgX还能与α、β-不饱和羰基化合物发生共轭的加成反应。
格氏试剂的制法是将卤代烃(常用氯代烷或溴代烷)乙醚溶液缓缓加入被乙醚浸泡着的镁屑中,加料速度应能维持乙醚微沸,直至镁屑消失,即得格氏试剂。反应是放热的,如果反应起动迟钝,可加一小粒碘来启动,一旦反应开始,乙醚发生沸腾后,乙醚的蒸气足以排除系统内空气的氧化作用,但不允许有水。格氏试剂易与空气或水反应,故制得后应就近在容器中反应。氯乙烯和结合在烯碳上的氯不能在乙醚中与镁反应,如用四氢呋喃代替乙醚,可制得氯化乙烯基镁试剂。这种试剂有人称为诺曼试剂。为了更好地启动镁与卤代烃的反应,可用少量1,2-二溴乙烷代替碘,特别是乙醚中如有少量水时,二溴乙烷与镁很快反应,生成溴化镁和乙烯,溴化镁有去水干燥作用,新鲜的镁与给定的卤代烃就可反应生成需要的格氏试剂。
4.格氏反应的通用方法
⑴ 无水乙醚的制备
检测过氧化物的方法:取5mL左右待处理的乙醚,加入等体积2%碘化钾溶液并滴入几滴稀盐酸,振摇后若使淀粉溶液呈紫色,即表明乙醚中含有过氧化物(也可用淀粉—碘化钾试纸检验;或者用5mL乙醚加1mL 10%碘化钾溶液,振摇1min后如有过氧化物则放出游离碘,水层则呈黄色,再加4滴0.5%淀粉液后,水层呈蓝色则表示乙醚中有过氧化物)。
检测水分的方法:在1mL乙醚溶液里加入约0.1g硫酸铜粉末,振荡后若硫酸铜粉末变成蓝色则表示有水存在,或者采用卡尔菲休法直接检测含水量,或者加入约3-4片二苯甲酮试剂,乙醚颜色变为漂亮的蓝色说明没有水存在,检其含水量应≤0.06%时就能符合发生格氏反应的要求了。
去除过氧化物的方法:将乙醚转入分液漏斗,加入相当于乙醚体积1/5的新配的FeSO4溶液(硫酸亚铁溶液的制备:取100 mL水,慢慢加入6 mL浓硫酸,再加入60 g硫酸亚铁溶解),剧烈振摇,静置分层,除去水相。然后,将除去过氧化物的乙醚分馏两次(不论何时都不要将乙醚蒸干),每次都收集33℃~37℃馏分。
去除水份的方法:先用无水氯化钙干燥(一般情况下,只要加入足量的CaCl2后放置3、4天,过滤后就可以直接使用了),再压入钠丝过夜,盖上带有毛细管的瓶盖,以便让产生的氢气逸出。当压入的钠丝表面仍具有光泽或溶剂中不再冒泡,表明溶剂可以用于格氏反应。
乙醚须保存在棕色玻璃瓶中。除去过氧化物的乙醚久置后仍然会产生过氧化物,而且乙醚很容易吸收空气中的水分。因此,处理后的乙醚应及早使用,不可久置。
⑵ 无水THF的准备
THF的水份越低越好,一般要在500ppm以下。工业生产中买回德国进口的THF一般不用干燥的,因为水份都在200 ppm以下约100 ppm左右。或者买回工业级的THF用4A分子筛干燥24~48h(使用之前,最好在300~400℃烘烤3小时活化后,在干燥器里冷却后直接放入要干燥的溶剂里),加入二苯甲酮作为指示剂,液体颜色变蓝时说明干燥好了。 关键是无水无氧操作。
N2保护的250mL四口烧瓶上,配置干燥洁净的搅拌器、恒压滴液漏斗和带有CaCl2和无水NaHCO3干燥管的回流冷凝管。向四口烧瓶中置入29.2g(1.2mo1)镁屑,用20mL?无水乙醚浸没(所用仪器均需干燥,溶剂和试剂都必须经过干燥处理)。
搅拌下,先滴入约占总量10%的卤代烃乙醚溶液(由0.1mol卤代烃和适量无水乙醚配制而成)。如果反应液呈现混浊状并且温度上升,表明反应已经引发成功。如果没有产生上述现象,则需要加入1~2小粒碘晶,并用电吹风微微加热至回流(可用热水浴加热,切不可用明火加热)碘的颜色开始渐渐消褪,溶液变混浊,反应即开始,迅速撤去加热源。将余下的卤代烃乙醚溶液滴 应瓶中,滴速以维持反应液平稳沸腾为宜。此时要剧烈搅拌,这样可冲刷掉在镁表面形成的粘稠的格氏试剂,使镁能和新鲜的卤化物接触良好顺利反应。反应引发成功后滴加的速度不能太快,约1滴 / 2秒。此时应控制反应温度,不能太高,用手背感觉其反应瓶壁的温度稍稍有些烫手即可。
滴毕,再用小火加热回流约半小时使反应完全,即得格氏试剂乙醚溶液(空气中的氧会与格氏试剂发生缓慢的氧化,格氏试剂的乙醚溶液在暗室里会发出美丽的光,就是这个缘故。因此格氏试剂不可久置,通常随制随用),其反应完成后颜色是发灰黑色的。若滴完以后烧瓶内仍有大量镁屑没反应完,可再加热回流1~2小时。
5.格氏试剂由什么组成 有什么作用
格氏试剂 Grignard reagent 一种金属有机化合物,通式RMgX(R代表烃基,X代表卤素)。
1901年由F.-A.V.格利雅首次使用卤代烃RX与镁在醚类溶液中反应制得。又称格利雅试剂。
格氏试剂广泛用于有机合成中,从RMgX可以制得RH、R—COOH、R—CHO、R—CH2OH、R—OH、CROHRR′、CRR′O和RnM(n为金属的化合价,M为其他金属)。在合适的情况下,RMgX还能与α、β-不饱和羰基化合物发生共轭的加成反应。
格氏试剂在醚的稀溶液中以单体形式存在,并与两分子醚络合,浓溶液中以二聚体存在。 原理 由于镁原子直接和碳链相连,极化作用的结果是使邻近镁原子的那个碳原子呈负电性,使得这根C-Mg键极具反应活性。
为了保证格氏试剂不发生其他反应,反应一般在醚类溶剂里进行,常用的有乙醚或四氢呋喃。在逆合成方法中,格林尼亚试剂是一种亲核烃基d1合成子。
6.格氏试剂制作的注意要点
格氏我做得可多了,这一年我可能做了几十个底物的格氏 格氏引发难的问题可能有以下几个原因: 1,Mg不新鲜,表面有被氧化的,导致不能与你的溴化物(或氯化物)不能很好接触。
(所以要求无氧) 2,THF的水分过多,导致被引发的格氏又被水份破坏了。 3,你按照你查到文献做可能更不好引发。
相信注意到上述3点你引发就没问题了,而你自身的偶联的原因大概有这么两个: 1,格氏试剂的浓度大了点 2,你引发的时候温度高了 你这个底物(对溴苯甲醚)应该好做的,我相信30度5分钟就能引发了,反应温度控制在25左右吧。 你所说的在加干燥管而没有氮气保护的情况下过夜36小时搅拌,结果格氏试剂变成白色的了,应该是变质了,里面的都应该是Mg(OH)2之累的东西 还有1点格氏试剂的颜色其实不是很重要,一般来讲白的比较好,但是做成黑的了也没撒关系,效果其实有时候差不多的。
你是不是刚工作呀?。
7.关于格氏试剂的全部反应
1、格氏反应卤代烃在无水乙醚或四氢呋喃中和金属镁作用生成烷基卤化镁RMgX,这种有机镁化合物被称作格氏试剂(Grignard Reagent)。
格氏试剂可以与醛、酮等化合物发生加成反应,经水解后生成醇,这类反应被称作格氏反应(Grignard Reaction)。格氏试剂是有机合成中应用最为广泛的试剂之一,它是由法国化学家格林尼亚(V.Grignard)发明的。
1871年,格林尼亚生于法国塞堡(Cherbourg Frace)。当他在里昂(Lyons)大学学习时,曾师从巴比亚(P.A.Barbier)教授。
当时,巴比亚主要从事有机锌化合物的研究,他以锌和碘甲烷反应得到二甲基锌,这种有机锌化合物被用作甲基化试剂。后来,巴比亚又以金属镁替代锌来进行尝试,也获得相似的金属有机化合物,不过反应条件比较苛刻。
于是。巴比亚便让格林那继续对有机镁化合物的制备作深入研究。
研究发现,用碘甲烷和金属镁在乙醚介质中反应可以方便地得到新的化合物,不经分离而直接加入醛或酮就会发生进一步反应,反应产物经水解后可以得到相应的醇。其反应过程可表示为:后来的研究表明,烷基卤化镁(即格氏试剂)可以用于许多反应,应用范围极广,因而很快成为有机合成中最常用的试剂之一。
格氏试剂的发明极大地促进了有机合成的发展,格林尼亚因此而获得1912年诺贝尔化学奖。通常,各种卤代烃和镁反应都可以生成格氏试剂。
不过,不同的卤代烃与镁反应活性有差异。一般来讲,当烷基相同时,碘代烷最易反应,氟代烃活性最差(实际上还没有人用氟代烃制RI>RBr>RCI>>RF 当卤素原子不变时,苄基卤代烃和烯丙基卤代烃活性最高,乙烯基卤代烃活性最低:ArCH2X、CH2=CHCH2X>30RX>20RX>10RX>CH2=CHX 格氏试剂对水十分敏感。
事实上,凡是具有活泼氢的化合物都可以和格氏试剂反应,例如醇、末端炔烃、伯胺及羧酸等。因此,在制备格氏试剂时,应该使用无水试剂和干燥的仪器。
此外,格氏试剂与空气中的氧也会发生反应,如: 2RMgX+O2==2ROMgX 不过,在以乙醚作溶剂的格氏反应中,由于乙醚的蒸气压较大,反应液被乙醚气氛所包围,因而空气中的氧对反应影响不明显。在格氏试剂制备中,溶剂的选择也是个关键。
通常选用绝对乙醚作溶剂。这是由于乙醚分子中的氧原子具有孤对电子,它可以和格氏试剂形成可溶于溶剂的配合物: 若使用其他溶剂,如烷烃,反应生成物会因不溶于溶剂而覆盖在金属镁表面,从而使反应终止。
除了乙醚外,四氢呋喃也是进行格氏反应的良好溶剂。尤其是当某些卤代烃,如氯乙烯、氯苯等在乙醚中难以和镁反应,若以四氢呋喃替代乙醚作溶剂,则可以顺利地发生反应。
由于四氢呋喃的沸点比乙醚高,因而以四氢呋喃作溶剂进行格氏反应比用乙醚要安全一些。 2、格氏反应通法 (1)无水乙醚的制备首先取少量待处理的乙醚,加入等体积2%碘化钾溶液并滴入几滴稀盐酸,振摇后若使淀粉溶液呈紫色,即表明乙醚中含有过氧化物(也可用淀粉-碘化钾试纸检验过氧化物)。
除去过氧化物的方法如下:将乙醚转入分液漏斗,加入相当于乙醚体积1/5的H2SO4亚铁溶液,剧烈振摇,静置分层,除去水相。然后,将除去过氧化物的乙醚分馏两次[1],每次都收集33℃~37℃馏分。
乙醚须保存在棕色玻璃瓶中,压入钠丝,盖上带有毛细管的瓶盖,以便让产生的氢气逸出。当压入的钠丝表面仍具有光泽,或溶剂中不再冒泡,表明溶剂可以用于格氏反应。
注意:除去过氧化物的乙醚,久王后仍然会产生过氧化物,而且乙醚很容易吸收空气中的水分。因此,处理后的乙醚应及早使用,不可久置。
(2)格氏试剂制备在250mL三口烧瓶上,配置搅拌器、恒压滴液漏斗和带有CaCl2干燥管的回流冷凝管[见图1.9(4)]。向三口烧瓶中置人2.9g(0.12mo1)镁屑,用20mL无水乙醚浸没[2]。
搅拌下,先滴入5mL 25%卤代烃乙醚溶液(由0.12mol卤代烃和无水乙醚配制而成)。如果反应液呈现混浊状并且温度上升,表明反应已经开始。
如果没有产生上述现象,则需要加入1~2小粒碘晶,并微微加热[3]。片刻,碘的颜色开始渐渐消褪,溶液变混浊,反应即开始,停止加热。
将余下的卤代烃溶液滴入反应瓶中,滴速以维持反应液平稳沸腾为宜。加毕,用温水浴加热回流约半小时,使反应完全,即得格氏试剂乙醚溶液[4]。
注释: [1] 不论何时都不要将乙醚蒸干。 [2] 所用仪器均需干燥。
溶剂和试剂都必须经过干燥处理。 [3] 可用热水浴加热,切不可用明火加热。
[4] 空气中的氧会与格氏试剂发生缓慢的氧化,格氏试剂的乙醚溶液在暗室里会发出美丽的光,就是这个缘故。因此,格氏试剂不可久置,通常随制随用。
格氏世试剂制备生产经验[加密0] 1. 水分(或是活泼质子)的影响是关键,也就是对原辅料的质量控制,和设备的干燥处理,在投料前没有将这些准备措施做好,将直接影响反应的进行,特别是反应的引发。本来是已经引发好了的,但是当滴加原料后,由于水分(或是活泼质子)的影响又将反应盖灭了。
于是这个在不引起操作人员注意的时候,等滴加液累积到一定的量后,一旦引发再次进行,将急剧反应放出大量的热,轻则冲料引起物料损失,重则发生爆炸事故。 。
8.有关格氏试剂的
这个R2CuLi叫做铜锂试剂,不是格氏试剂。
锂的烷基衍生物。包括正丁基锂、甲基锂、苯基锂等。它们常用作试剂,其中以正丁基锂溶液最常用。烷基锂能对羰基化合物进行加成反应,还能对活泼氢进行置换反应,以及卤素-锂交换反应,其反应性能比一般格氏试剂要广泛而且多样化。它与多种金属有机物形成的金属锂衍生物广泛用于有机合成。甲基锂和甲基亚铜在醚类溶液中组成二甲基铜锂(CH3) 2CuLi,是一个极其重要的甲基化试剂,它对不饱和的或芳香族的卤素化合物都能进行甲基置换卤素的反应。锂与三甲基氯硅烷反应生成的(CH3) 3SiLi是重要的硅化试剂,对保护烯醇或羟基有多种用途。
正丁基锂可从氯丁烷与金属锂在戊烷或其他液体烷烃中反应制得。甲基锂、苯基锂等可从相应的卤代烃来制备,现做现用,其活性同格利雅试剂相似。甲基锂在溶液中为四聚体,常需要加N,N,N′,N′-四甲基乙二胺来解聚活化。
说简单一点就是RX+Li->RLi+CuI->R2CuLi+RX->R-R
而格式试剂指的是RMgX,是RX与Mg在无水乙醚中化合而成的。
格氏试剂 Grignard reagent
一种金属有机化合物,通式RMgX(R代表烃基,X代表卤素)。1901年由F.-A.V.格利雅首次使用卤代烃RX与镁在醚类溶液中反应制得。又称格利雅试剂。格氏试剂广泛用于有机合成中,从RMgX可以制得RH、R—COOH、R—CHO、R—CH2OH、R—OH、CROHRR′、CRR′O和RnM(n为金属的化合价,M为其他金属)。在合适的情况下,RMgX还能与α、β-不饱和羰基化合物发生共轭的加成反应。
格氏试剂的制法是将卤代烃(常用氯代烷或溴代烷)乙醚溶液缓缓加入被乙醚浸泡着的镁屑中,加料速度应能维持乙醚微沸,直至镁屑消失,即得格氏试剂。反应是放热的,如果反应起动迟钝,可加一小粒碘来启动,一旦反应开始,乙醚发生沸腾后,乙醚的蒸气足以排除系统内空气的氧化作用,但不允许有水。格氏试剂易与空气或水反应,故制得后应就近在容器中反应。氯乙烯和结合在烯碳上的氯不能在乙醚中与镁反应,如用四氢呋喃代替乙醚,可制得氯化乙烯基镁试剂。这种试剂有人称为诺曼试剂。为了更好地启动镁与卤代烃的反应,可用少量1,2-二溴乙烷代替碘,特别是乙醚中如有少量水时,二溴乙烷与镁很快反应,生成溴化镁和乙烯,溴化镁有去水干燥作用,新鲜的镁与给定的卤代烃就可反应生成需要的格氏试剂。
格氏试剂在醚的稀溶液中以单体形式存在,并与两分子醚络合,浓溶液中以二聚体存在。
1912年,诺贝尔化学奖授予法国化学家维克多·格林尼亚。他发现了金属镁与许多卤代烃的醚溶液反应,生成了一类有机合成的中间体——有机金属镁化合物,即格氏试剂。
维克多·格林尼亚的家庭很富有,但他不爱读书,成为“没出息的花花公子”。1892年,在一次宴会上,他邀请一位姑娘跳舞。姑娘拒绝,并说她最讨厌他这样的花花公子。他受此羞辱,悔恨交加,终于猛醒过来,决心抛弃恶习,奋发上进。他离开了家庭,补习功课两年后,终于考取了里昂大学化学系。经过大学7年的刻苦学习,于1901年获得了博士学位,后来历任南希大学、里昂大学教授。
相关推荐
声明:本网站尊重并保护知识产权,根据《信息网络传播权保护条例》,如果我们转载的作品侵犯了您的权利,请在一个月内通知我们,我们会及时删除。
蜀ICP备2020033479号-4 Copyright © 2016 学习鸟. 页面生成时间:2.967秒









