微生物裂解方法(哪些方法可以裂解大肠杆菌)
1.哪些方法可以裂解大肠杆菌
裂解细菌的方法和裂解细胞的方法是很相似的,下面是裂解细胞的方法:细胞的破碎方法 1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度.此法适用于动物内脏组织、植物肉质种子等.2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织.3.超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察.对超声波及热敏感的蛋白和核酸应慎用.4.反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎.5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml.无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取.^__^。
2.微生物分离方法
微生物分离法是获得微生物纯培养物的一种分离方法。通过这个方法可实现一种微生物的培养,或获得一个细胞的后代。其具体方法有:
1、稀释倒平皿法。将待分离的材料作一系列稀释,取不同稀释度适量涂布于固体培养基平板上或与已熔化的固体培养基一起倾注入平板内,经过培养即有一个微生物细胞繁殖来的单个菌落。
2、划线法。先将已熔化的固体培养基制成平板,待凝后,取分离材料在上面划线,可作平行划线、扇形划线或其他形状的连续划线,使菌样逐渐减少,最后得到单个孤立的菌落。
扩展资料:
微生物分离技术的应用措施:
1、减少毒性氧物质的毒害作用:由于常规培养方法使用的高浓度营养基质不利于微生物生长,适当降低营养基质的浓度可以减弱这种不利影响。发现低浓度基质的培养基培养出的细菌在数量和种类上均多于高浓度基质的培养基,但营养浓度过低时会使培养出的微生物数量反而下降。
2、维持微生物间的相互作用:在培养基中加入微生物相互作用的信号分子就可简单模拟微生物间的相互作用,满足微生物生长繁殖的要求。
3、供应新型的电子供体和受体:不同微生物的代谢过程不同,因此对反应的底物要求也不尽相同。供应微生物需要的特有底物有助于新陈代谢反应的进行及微生物的正常生长。大量的研究表明,将新颖的电子供体和受体应用到微生物培养中,能够发现未知的生理型微生物。
4、分散微生物细胞:自然界中很多微生物聚集生长,形成“絮体”和“颗粒”等,致使其内部的微生物不易被培养。对“絮体”和“颗粒”进行适度的超声处理,将细胞分散再进行培养,可以使更多的微生物接触培养基而得到培养。
5、延长培养时间:对“寡营养菌”的培养,可适当延长培养时间,使其能长至肉眼可见的尺度。当然培养时间不能无限增长,因为培养时间越长,对培养环境的无菌要求就越高 [4] 。
6、利用琼脂替代物:琼脂对某些微生物具有毒性作用,采用无害且凝结作用较好的替代物质作为培养基固化剂,可以增加微生物的可培养性。
参考资料来源:百度百科——微生物分离法
3.分离纯化微生物的方法有哪些
主要有
1、稀释倒平板法
首先把微生物悬液作一系列的稀释(如1:10、1:100、1:1000、1:10000),然后分别取不同稀释液少许,来与已熔化并冷却至50℃左右的琼脂培养基混合,摇匀后,倾入灭过菌的培养皿中,待琼脂凝固后制成可能含菌的琼脂平板,保温培养一定时间即可出现菌落。如果稀释得当,在平板表面或琼脂培养基中就可出现分散的单个菌落,自这个菌落可能就是由一个细菌细胞繁殖形成的。随后挑取该单个菌落,或重复以上操作数次,便可得到纯培养。
2.、稀释涂布平板法
将已熔化的培养基倒入无菌平皿,制成无菌平板,冷却凝固后,将一定量的微生物悬液滴知加在平板表面,再用无菌玻璃涂棒将菌液均匀分散至整个平板表面,经培养后挑取单个菌落。
3、平板划线法
将微生物样品在固体培养基表面多次作“由点到线”稀释而达到分离。
4、稀释摇管法
先将一系列盛无菌琼脂培养基的试管加热使琼脂熔化后冷却并保持在50℃左右,将待分离的材料用这些试管进行梯度稀释,试管迅速摇动均匀,冷凝后,在琼脂柱表面倾倒一层灭菌液体石蜡和固体石蜡的混合物,将培养基和道空气隔开。
4.自然条件下原核微生物基因重组的方式有哪些类型
原核微生物的基因重组 (一)转化 (transformation) 转化是细菌中最早被发现的遗传物质转移形式。
l928 年 Griffith 用肺炎链球菌对小鼠的感染实验以及 10 多年后 Avery 等体外转化过程的实现,转化因子 DNA 的证实,是现代生命科学发展的重要起点。 1 .几个概念 转化 受体菌直接吸收了来自供体菌的 DNA 片段,通过交换把它整合到自己的基因组中,从而获得了新的遗传特性的现象。
转化子( transformant ) 受体细胞经复制分裂后出现了供体性状的子代。 感受态 (competence) 细菌能够从周围环境中吸收 DNA 分子进行转化的生理状态。
(二) 转导 (transduction) 1952 年 Zinder 和 Lederberg 在验证鼠伤寒沙门氏菌是否也存在接合现象时发现了转导现象。 通过完全缺陷或部分缺陷噬菌体为媒介,把供体细胞的 DNA 片段携带到受体细胞中,通过交换与整合,从而使后者获得前者部分遗传性状的现象,称为转导。
获得新性状的受体细胞,称为转导子 (transductant) 。携带供体部分遗传物质 (DNA 片段 ) 的噬菌体称为转导噬菌体。
在噬菌体内仅含有供体菌 DNA 的称为完全缺陷噬茵体;在噬菌体内同时含有供体 DNA 和噬菌体 DNA 的称为部分缺陷噬菌体 ( 部分噬菌体 DNA 被供体 DNA 所替换 ) 。根据噬菌体和转导 DNA 产生途径的不同,可将转导分为普遍性转导和局限性转导。
1 .普遍性转导 (general transduction) 通过完全缺陷噬菌体对供体菌任何 DNA 小片断的“误包”,而实现其遗传性状传递至受体菌的转导现象,称为普遍性转导。 普遍性转导的机制——“包裹选择模型”,当噬菌体侵染敏感细菌并在细菌内大量复制增殖时,亦把寄主 DNA 降解为许多小的片段,在装配时,少数噬菌体 (10 -6 一 10 -8 ) 错误地包装了宿主的 DNA 片段并能形成“噬菌体”,这种噬菌体称普遍性转导噬菌体 ( 为完全缺陷噬菌体 ) 。
随着细菌的裂解,转导噬菌体也被大量释放。当这些转导噬菌体再次侵染受体菌时,其中的供体 DNA 片段被注入受体菌。
如果该 DNA 片段能与受体菌 DNA 同源区段配对,通过遗传物质的双交换而进行基因重组并形成稳定的转导子,称完全普遍性转导。如鼠伤寒沙门氏菌的 P22 噬菌体、大肠杆菌的 P1 噬菌体和枯草芽孢杆菌的 PBS1 和 SP10 等噬菌体中都能进行完全转导。
如果该 DNA 片断不能与受体菌 DNA 进行交换、整合和复制,只以游离和稳定的状态存在,而仅进行转录、转译和性状表达,称流产转异。发生流产转导的细胞在其进行分裂后,只能将这段外源 DNA 分配给一个子细胞,而另一子细胞仅获得供体基因转录、转译而形成的少量产物 -- 酶,因此在表型上仍可出现轻微的供体菌特征,每经分裂一次,就受到一次“稀释”。
所以能在选择培养基上形成微小菌落就成了流成转导子的特点。 2 .局限性转导 (specialized transduction) 通过部分缺陷噬的温和噬菌体把供体菌的少数特定基因携带到受体菌中,并获得表达的转导现象)。
转导后获得了供体部分遗传特性的重组受体细胞称为局限转导子。 (1) 局限性转导的机制——“杂种形成模型” λ噬菌体的线状双链 DNA 分子的两端为 12 个核苷酸单链(粘性未端 cos 位点),在溶源状态下,以前噬菌体状态存在于细胞染色体上。
被诱导后,在裂解细菌时,其以粘性末端形成的环状分子通过滚环复制形成一个含多个基因组的 DNA 多联体,以 2 个 cos 位点之间的距离决定其包装片段的大小而进行切割、包装,最终形成转导噬菌体。在极少数情况下 ( 约 10 -5 ) ,在前噬菌体两端邻近位点上与细菌染色体发生错误的切割,使其重新形成的环状 DNA 中,同时失去前噬菌体的一部分 DNA 和增加了一段相应长度的细菌宿主染色体 DNA ,这样形成的杂合 DNA 可正常被包装、复制。
形成的新转导噬菌体称为部分缺陷噬体。因为λ前噬菌体位点两端是细菌染色体的 gal + ( 发酵半乳糖基因 ) 和 bio + ( 利用生物素基因 ) ,故形成的转导噬菌体通常带有 gal + 或 bi0 + 基因,故这些部分缺陷噬菌体表示为λ dga1( 缺陷型半乳糖转导噬菌体 ) 或λ dbio( 缺陷性生物素转导噬菌体 ) 。
这些转导噬菌体可重新侵入受体菌,侵入后,噬菌体 DNA 与受体菌的 DNA 同源区段配对,通过双交换而整合到受体菌的染色体组上,使受体菌获得了供体的这部分遗传特性。 ( 2 )局限性转导中的低频转导与高频转导 低频转导 (LFT) :由于宿主染色体上进行不正常切离的频率极低,因而在裂解物中所含的部分缺陷噬菌体的比例是极低( 10 -4 --10 -6 )的,这种裂解物称为 LFT 裂解物。
LFT 裂解物在低 m.o.i(multiplicity of infection) 情况下感染宿主,就可获得极少量的转导子。高频转导 (HFT) :形成转导子的频率很高,理论上可达 50 %,故称之为高频转导。
其原因是因为供体菌为双重溶源菌,它同时有两种噬菌体整合在细菌的染色体上。例如,大肠杆菌 K12 株,其双重溶源菌为 E.coli K12( λ / λ dg), 即其前噬体体有λ和λ dg 为缺陷噬菌体,带有供体 gal + 基因,但丢失了部分噬菌体本身的 DNA ;而λ噬菌体为正常噬菌体,不带 gal 基因,但起辅助作用,称为辅助噬菌体,可弥补λ dg 的不足,使λ dg 也能。
5.微生物纯种分离的方法有哪些
自然界中的微生物总是杂居在一起 即使一粒土或一滴水中也生存着多种微生物 要研究其中某一种微生物 首先必须将它分离出来 下面介绍几种纯种微生物的分离方法
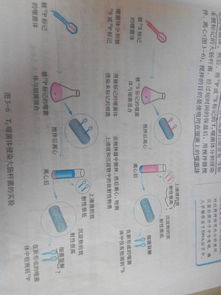
平板划线分离 将已经熔化的培养基倒入培养皿中制成平板 用接种环沾取少量待分离的材料 在培养基表面平行或分区划线(图5-5)然后 将培养皿放入恒温箱里培养 在线的开始部分 微生物往往连在一起生长 随着线的延伸 菌数逐渐减少 最后可能形成纯种的单个菌落
液体稀释法 将待分离的样品经过大量稀释后 取稀释液均匀地涂布在培养皿中的培养基表面 培养后就可能得到单个菌落
利用选择培养基进行分离 不同的微生物对不同的试剂 染料 抗生素等具有不同的抵抗能力 利用这些特点可配制出适合某种微生物生长而限制其他微生物生长的选择培养基 用这种培养基来培养微生物就可以达到纯种分离的目的
菌丝尖端切割 这种方法适于丝状真菌 用无菌的解剖刀切取位于菌落边缘的菌丝的尖端 将它们移到合适的培养基上培养后 就能得到新菌落
6.微生物计数方法有哪些
测定微生物计数的方法有很多,主要有以下几种:
1.血细胞计数法
将稀释的菌液样品滴在血细胞计数板上,在显微镜下计算4~5个中格的细菌数,并求出每个小格所含细菌的平均数,再以此为依据,估算总菌数.
①此法的缺点是不能区分死菌和活菌.
②对压在小方格界线上的细菌,应当取平均值计数.
③此法可用于测定培养液中酵母菌种群数量的变化
2.稀释涂布平板法
原理:每个活细菌在适宜的培养基和良好的生长条件下可以通过生长形成菌落.培养基表面生长的一个菌落,来源于样品稀释液中的一个活菌.
①这一方法常用来统计样品中活菌的数目
②统计的菌落数往往比活菌的实际数目低,原因是当两个活多个细胞连在一起时,平板上观察到的只是一个菌落.因此统计结果一般用菌落数而不是用活菌数来表示.
③土壤、水、牛奶、食品和其他材料中所含细菌、酵母、芽孢与孢子等的数量均可用此法测定.但不适于测定样品中丝状体微生物,例如放线菌或丝状真菌或丝状蓝细菌等的营养体等.
④此法若不培养成菌落,可通过将一定量的菌液均匀地涂布在玻片上的一定面积上,经固定染色后在显微镜下计数,这样又称涂片计数法.染色可用台盼蓝,台盼蓝能使死细胞染成蓝色,可分别计数死细胞和活细胞.
3.滤膜法
滤膜法是当样品中菌数很低时,可将一定体积的湖水、海水或饮用水灯样品通过膜过滤器.然后将滤膜干燥、染色,并经处理使膜透明,再在显微镜下计算膜上(或一定面积上)的细菌数.
此法也可以通过培养观察形成的菌落数来推算样品中的菌数.例如测定饮用水中大肠杆菌的数目:将已知体积的水过滤后,将滤膜放在伊红美蓝培养基上培养.在该培养基上大肠杆菌的菌落呈现黑色,可根据培养基上黑色菌落的数目,计算出水样中大肠杆菌的数目.
此法也是统计样品中活菌的数目.
4.比浊法
原理是在一定范围内,菌是悬液中细胞浓度与混浊度成正比,即与光密度成正比,菌越多,光密度越大.因此可借助与分光光度计,在一定波长下,测定菌悬液的光密度,以光密度表示菌量.实验测量时一定要控制在菌浓度与光密度成正比的线性范围内,否则不准确.
5.显微镜直接计数法
在课本生物选修1生物技术实践P22中“除了上述活菌计数法外,显微镜直接计数也是测定微生物数量的常用方法.”这里说的显微镜直接计数,我认为应该是在稀释涂布的基础上不培养成菌落而通过染色的方法在显微镜下直接计数.再如滤膜法也一样,可以有两种情况.
另外,微生物计数法发展迅速,多种多样的快速、简易、自动化的仪器和装置等方法可以用来统计微生物的数目.
7.微生物分解代谢途径有哪些
1)EMP途径:以1分子葡萄糖为底物反应产生2分子丙酮酸,2分子NADH+氢离子和2分子ATP。
EMP途径是绝多数生物所共有的一条主流代谢途径。 (2)HMP途径:是从葡糖-6-磷酸开始的,其特点是葡萄糖不经EMP途径和TCA循环而得到彻底氧化,并能产生大量还原型烟酸胺腺嘌呤二核苷酸磷酸以及重要中间代谢产物。
在多数好氧菌和兼性厌氧菌种都存在HMP途径,而且通常还与EMP途径同时存在。只有HMP途径而无EMP途径的微生物很少,例如弱氧化醋杆菌,氧化葡糖杆菌,氧化醋单胞菌。
(3)ED途径:以1分子葡萄糖为底物生成2分子丙酮酸,1分子ATP,1分子NADPH和NADH。其特点是只经过4步反应即可快速获得由EMP途径须经10步反应才能形成的丙酮酸。
ED途径在革兰氏阴性菌中分布较广,特别是假单胞菌和固氮菌的某些菌中较多存在,是缺乏完整EMP途径的微生物中的一种替代途径。ED途径可不依赖于EMP途径和HMP途径而单独存在。
(4)TCA途径:以1分子丙酮酸为底物,经过一系列循环反应而彻底氧化,脱羧形成3分子CO2,4分子NADH2,1分子FADH2和1分子GTP,总共相当于15分子ATP,产能效率极高。这是一个广泛存在于各生物体中的重要生物化学反应,在各种好氧微生物中普遍存在。
这是我找到,如果有问题,请追问我帮你翻书。
声明:本网站尊重并保护知识产权,根据《信息网络传播权保护条例》,如果我们转载的作品侵犯了您的权利,请在一个月内通知我们,我们会及时删除。
蜀ICP备2020033479号-4 Copyright © 2016 学习鸟. 页面生成时间:2.715秒









